Химия - это наука о веществах.Для измерения вещества была выбрана особая единица, в которой соединилось число молекул и масса вещества. Эта единица названа
моль.
Экспериментально установлено, что
1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6*1023. В честь итальянского ученого Амедео Авогадро это число назвали
постоянной Авогадро. Обозначается оно NА. Масса 1 моль вещества называется молярной массой и обозначается буквой
М.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
В 1803 и 1804 годах он, совместно со своим братом Феличе, представил в Туринскую академию наук две работы, посвященные теории электрических и электромагнитных явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснил поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых. В 1806 году Авогадро получает место репетитора в Туринском лицее. В 1809 переводится преподавателем физики и математики в лицей города Варчелли.
В сентябре 1819 года Авогадро избирается членом Туринской академии наук. В 1820 году королевским указом Авогадро назначается первым профессором новой кафедры высшей физики в Туринский университет. В 1822 году Туринский университет был закрыт властями после студенческих волнений. В 1823 году Авогадро получает почетный титул заслуженного профессора высшей физики и назначается старшим инспектором в палату по контролю за государственными расходами. Несмотря на новые обязанности, Авогадро продолжал заниматься научными исследованиями.
В 1832 году Туринский университет вновь получил кафедру высшей физики, но ее предложили не Авогадро, а известному французскому математику Огюстену Луи Коши, покинувшему родину в 1830 году. Только спустя два года, после отъезда Коши, Авогадро смог занять эту кафедру, где и проработал до 1850 года. В этом году он ушел из университета, передав кафедру своему ученику Феличе Кью. После ухода из университета Авогадро некоторое время занимал должность старшего инспектора Контрольной палаты, а также состоял членом Высшей статистической комиссии, Высшего совета народного образования и председателем Комиссии мер и весов. Несмотря на почтенный возраст, он продолжал публиковать свои исследования в трудах Туринской академии наук. Последняя его работа вышла из печати за три года до смерти, когда Авогадро исполнилось 77 лет. Он умер в Турине 9 июля 1866 года и похоронен в семейном склепе в Верчелли.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.


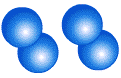
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислорода